
غزل کیماسی
5 ماه پیش
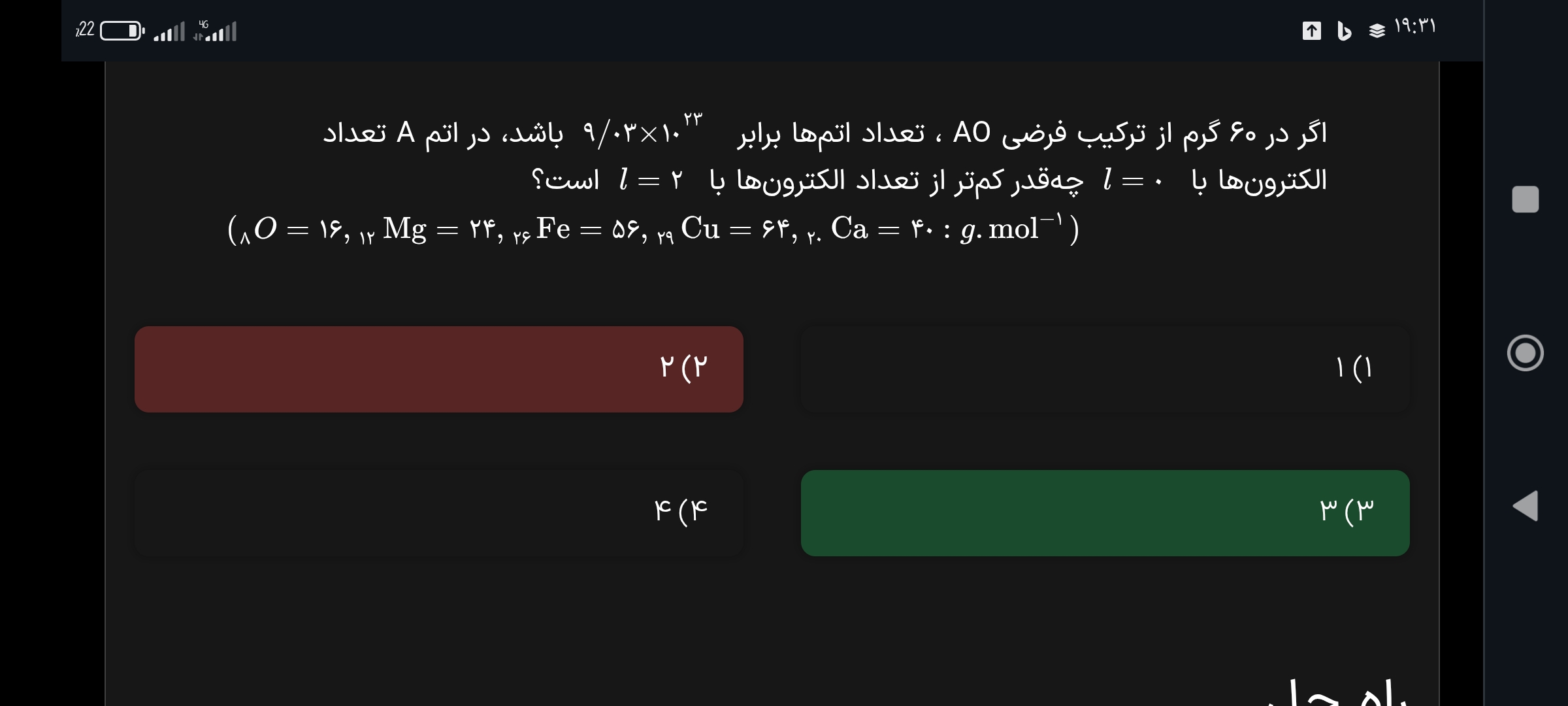
سلام پاسخ این سوال ، به صورت کسری حل کرده ، من از روش استاد حل میکنم جواب در نمیاد میشه لطفا از روش استاد این سوالو حل کنید ، اون قسمت عدد جرمی A رو دراوردن مشکل دارم

فاطمه کردی
10 ماه پیش
اگه تو گزینه ج گفته بود مجموع اعداد کوانتومی n+l لایه ظرفیت اون موقع میشد (4=0+4) + (5=1+4) =9

سید محمد متین رشادی

10 ماه پیش
بله منطقا ولی من تا حالا ندیدم جایی این شکلی بگن مثلا اگر بگه مجموع n و l زیرلایه های مربوط به لایه ظرفیت،اونوقت منطقی تره و با روش شما میتونیم بریم🌷
(1)

فاطمه کردی
10 ماه پیش
@سید محمد متین رشادی من بیشتر خودم مونده بودم که چه زمانی باید الکترون ها رو در n یا l ضرب کنیم و یا اینکه چه زمانی نیاز نیست فقط همون n+l تنها پاسخ درسته برا همین این سوالو پرسیدم که مطمعن تر شم برا چه سوالی کدوم روشش درسته

فرشته پرتوی
1 سال پیش
سلام میشه مورد دوم هم توضیح بدید

فرشته پرتوی
1 سال پیش
@زینب مقدم یعنی نمی تونه عدد اکسایش هفت داشته باشه

امیر حسین عبدی
1 سال پیش
ج)منظور از (الکترون های لایه طرفیتی سومین عضو آن) یعنی چی؟؟! سومین لایه رو میگه در نظر بگیریم؟

نرگس مهدوی

1 سال پیش
خانواده هالوژن ها شامل فلوئور، کلر و برم و ... میشه سومین عضو این خانواده میشه برم

امیررضا طهماسبی
1 سال پیش
داداش گروه 17 میشه هالوژن
الیزا ساعی
1 سال پیش
چرا استاد در مورد ج ،۲بار حساب کردن و توان s و p رو هم تاثیر دادن؟
(1)

سید محمد متین رشادی

1 سال پیش
چون برای هر الکترون جداگانه باید ضرب بشه مثلا وقتی دوتا الکترون داریم که هر کدوم عدد کوانتومی اصلیشون ۴ هست،پس باید دو را در چهار ضرب کنیم یعنی هشت تا و ... اوکی؟ یعنی هر الکترون رو جداگانه جمع میکنیم اعداد کوانتومیش رو
اسرا عباسی
1 سال پیش
گزینه ج نفهمیدم چی شد میشه توضیح بدین

نرگس مهدوی

1 سال پیش
سلام بعد اینکه سومین عضو خانواده هالوژن ها رو پیدا کردین ارایش الکترونی اون رو می نویسین لایه ظرفیتش رو پیدا می کنین حالا برای هر الکترون مقدار n+l رو باید محاسبه کنین وقتی دو تا الکترون توی 4s دارین یعنی دو تا الکترون با n=4 و l=0 مجموع n+l برای این الکترون ها میشه ۸ حالا همین رو برای لایه 4p که ۵ تا الکتزون داره هم باید به دست بیارین و با هم جمع کنین
(1)

مهشید خوبان
1 سال پیش
الان استاد اینو از کجا فهمید که گروه هفده رو میگه
(1)

فرشته پرتوی
1 سال پیش
هالوژن ها گروه هفده هستند فلزات قلیایی گروه یک هستند

عرشیا برزگران
2 سال پیش
سلام چرا گروه 17 خانواده ی هالوژن نامیده شده؟؟

زینب مقدم

2 سال پیش
سلام هالوژن ینی نمک ساز و عناصر گروه ۱۷ در ترکیب با فلزات گروه ۱ نمک میسازن مثل NaCl
الهام دلاورزاده
2 سال پیش
میگم ببخشید تعدا حل تست ها رو بیشتر نمی کنید یعنی تست های بیشتری حل کنید
(1)

زینب مقدم

2 سال پیش
سلام الهام جان ممنون از کامنتت منتقل میکنم

امیرحسین آقایی
2 سال پیش
سلام حفظ در جدول تناوبی چطوری حفظش کنیم مثلا اینطوری که بگیم هیدروژن ۱ هلیم ۲ لیتیم ۳ برایم ۴ بور ۵ کربن ۶ نیتروژن ۷ اکسیژن ۸ و اگر بخواییم گروه و تناوبش را پیدا کنیم بر اساس آرایش الکترونیش پیدا کنیم یا با حفظ هم گروه هم تناوبش را حفظ کنیم کدام روش بهتر است؟

محمدحسین جعفربگلو
2 سال پیش
سلام مورد ب رو میشه بگید چرا غلطه

محمدحسین جعفربگلو
2 سال پیش
فقط فلویور عدد اکسایش بزرگتر از 1میسازه چون الکترونگاتیوی قوی تری داره؟

زینب مقدم

2 سال پیش
@محمدحسین جعفربگلو سلام فلوئور منفی یک میشه که از صفر کوچیکتره ینی چون الکترونگاتیوی قویتری داره، بار منفی میگیره

محمدحسین جعفربگلو
2 سال پیش
@زینب مقدم بله درسته ممنون.. منم منظورم اکسیژن بود که گفتم مثبت میشه مچکر(:
(1)














سید محمد متین رشادی
8 ماه پیش
جواب به صورت صوتی می باشد:)