یادبگیریم2:نیروی بین مولکولی و نقطه جوش

نیاز سعادتی
2 هفته پیش
سلام استاد گفتن نیروی بین مولکولی با نقطه جوش رابطه مستقیم دارد پس چرا HBrبا نقطه جوش کمتر ازHClبا نقطه جوش بیشتر ،نیروی بین مولکولی قوی تری دارد؟!

حیدر مالداری
1 ماه پیش
کلا در جدول تناوبی به جز مولکول هایی که پیوند هیدروژنی دارند آیا شعاع اتمی با جرم اتمی رابطه مستقیم یا معکوس داره که همه جا صدق کنه؟ یا قانون مشخصی نداره؟؟؟؟ جرم با نقطه جوش چطور؟

. .
1 هفته پیش
شعاع اتمی به مکانشون تو جدول تناوبی بستگی داره. شما از بالا به پایین جدول که میری شعاع بیشتر می شه که با افزایش جرم اتمی رابطه مستقیم داره. اما حالت دومش هم اینه که وقتی از راست به چپ حرکت می کنی شعاع اتمی افزایش پیدا می کنه که این با جرم مولکولی رابطه عکس داره. یعنی کلا به جرم ربط نداره. بحث نیروهای بین مولکولشیونه که مفصل تو یازدهم می خونی.

سبحان پرهوده
1 ماه پیش
نیرو درون مولکولی رو میشه با الکترونگاتیوی توجیح کرد یا نه چون بازم جواب همونه

. .
1 هفته پیش
در اصل برمیگرده به انتالپی های پیوندشون

راضیه شیخان
3 ماه پیش
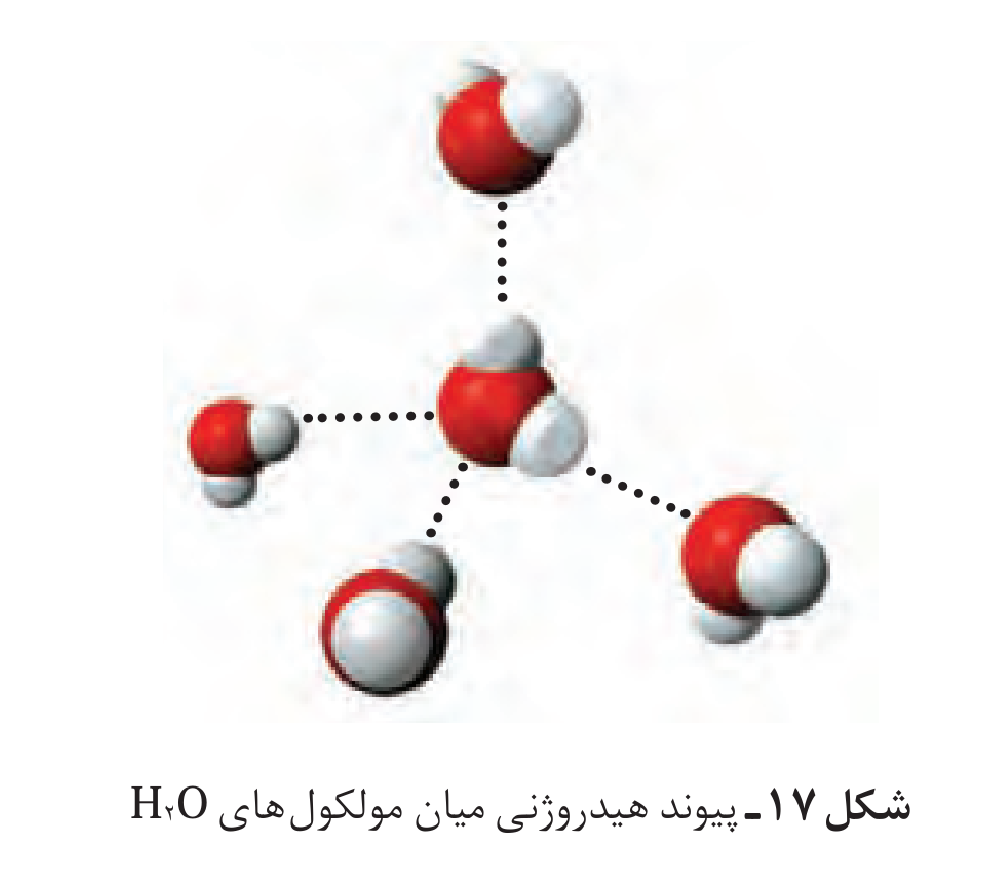
سلام میشه ساختار آب رو توضیح بدید که چجوری یه مولکول آب به مولکول آب دیگه وصل میشه

امیرمهدی باغستانی
4 ماه پیش
سلام وقت بخیر ی سوال داشتم چرا استاد اینجا نیروهای درون مولکولی رو نگفتند؟

غزل اسماعیل زاده
4 ماه پیش
سلام:) جلوتر داخل دقیقه 9 توضیح دادن. این مبحث مال سال یازدهمه اگه یازدهم یا کنکوری هستین ب دردتون میخوره.
(1)

امیرمهدی باغستانی
4 ماه پیش
@غزل اسماعیل زاده ممنونم ❤️
z z
4 ماه پیش
سلام ببخشید اگر در جدول مندلیف به سمت پایین جدول پیش بریم شعاع بزرگ میشه اگر عنصر ها در یک گروه باشند؟؟؟؟؟

سید محمد متین رشادی

4 ماه پیش
سلام بله 🌷

زهرا خانی
4 ماه پیش
سلام وقت بخیر ترتیب مقدار نیروی بین مولکولی به این صورت هست: جامد>مایع>گاز این مقایسه رو فقط برای مولکول های ناقطبی در نظر میگیریم؟ برای قطبی ها و پیوند هیدروژنی ها چطور؟ چون در کتاب گفته شده که وقتیH²O به صورت گاز درمیاد اصلا جاذبه هیدروژنی نداره

روژان کنگرانی فراهانی
8 ماه پیش
سلام استاد چندین بار در مورد قطبیت بین hcl و hbr و hi اشتباه کردن. قطبیت بیشتر به ترتیب f>o>n>CL>BR>I>S>C>H

Tara :)
7 ماه پیش
سلام استاد نیروی پیوند مولکولی اون ها رو مقایسه کردن نه تک تک اتم ها فکر میکنم متفاوت باشن

آمیار نالوسی
5 ماه پیش
قطبیت برای اتم تعریف نمیشه دوست من و اصلا استاد مقدار قطبیت هارو مقایسه نکرد فقط نیروی بین مولکولی و آنتالپی پیوندشون (قدرت پیوند کووالانسی) رو مقایسه کرد
(1)
آرتمیس آرین
8 ماه پیش
ببخشید اینجارو اصلا متوجه نمیشم میشت یه توضیح کوچولو بدین؟

Tara :)
7 ماه پیش
سلام روز خوش:) به پیوند هیدروژنی بین اتم های یه مولکولی اشاره میکنن:وقتی که یکی از اتم های F, O, N با اتم H پیوند تشکیل بدن و H که تو این پیوند وجود داره دوباره با یکی از اتم های F, O, N مولکول دیگه پیوند تشکیل میده بهش میگن پیوند هیدروژنی.مثلا تو مولکول آب که دو تا هیدروژن داره که از یه طرف به اکسیژن وصلن میان با اکسیژن های یه مولکول دیگه از آب پیوند میدن که صورت کلیش میشه پیوند هیدروژنی.

فاطمه بیاتی
8 ماه پیش
سلام میشه این جمله از کتاب را برام توضیح دهید ( در مواد مولکولی با جرم مولی مشابه ماده با مولکول های قطبی نقطه جوش بالاتری دارد )

زهرا حافظی
9 ماه پیش
سلام ببخشید اگر جرم هامون متفاوت باشه بازم نیروی بین مولکولی قطبی قوی تر از ناقطبی است؟

سید محمد متین رشادی

9 ماه پیش
اگر ویس ناواضح بود بگید دوباره ضبط کنم ریپلای نکنید 🌷 البته اینکه کدومشون دارای پیوند هیدروژنی باشه هم خیلی مولفه مهم و کمک کننده ای هست

غزل افتخاری
9 ماه پیش
سلام ببخشید استاد آخرای ویدئو که داره باهم باندیشیم رو توضیح میده میگه که اتانول پیوند هیدروژنی داره ؟ مگه هر دوتاشون پیوند هیدروژنی ندارن !! آخه استون هم ، هم هیدروژن داره و هم اکسیژن.

سید محمد متین رشادی

9 ماه پیش
سلام در صورتی که اتم اکسیژن متصل به هیدروژن باشه،پیوند هیدروژنی داره استون هیدروژن و اکسیژن داره ولی هیدروژن متصل به اکسیژن،نداره
یگانه احمدی
9 ماه پیش
سلام وقتتون بخیر ترکیبی که بیشترین نیروی بین مولکولی رو داشته باشه ضعیف ترین نیروی درون مولکولی رو داره؟
(1)










. .
1 هفته پیش
نقطه جوش HBr از نقطه جوش HCl بیشتره. اون منفی 67 عه ولی HCl منفی 85. نیروی بین مولکولیشم از HCl بیشتره