
نیاز سعادتی
2 هفته پیش
سلام استاد گفتن نیروی بین مولکولی با نقطه جوش رابطه مستقیم دارد پس چرا HBrبا نقطه جوش کمتر ازHClبا نقطه جوش بیشتر ،نیروی بین مولکولی قوی تری دارد؟!

حیدر مالداری
1 ماه پیش
کلا در جدول تناوبی به جز مولکول هایی که پیوند هیدروژنی دارند آیا شعاع اتمی با جرم اتمی رابطه مستقیم یا معکوس داره که همه جا صدق کنه؟ یا قانون مشخصی نداره؟؟؟؟ جرم با نقطه جوش چطور؟

. .
1 هفته پیش
شعاع اتمی به مکانشون تو جدول تناوبی بستگی داره. شما از بالا به پایین جدول که میری شعاع بیشتر می شه که با افزایش جرم اتمی رابطه مستقیم داره. اما حالت دومش هم اینه که وقتی از راست به چپ حرکت می کنی شعاع اتمی افزایش پیدا می کنه که این با جرم مولکولی رابطه عکس داره. یعنی کلا به جرم ربط نداره. بحث نیروهای بین مولکولشیونه که مفصل تو یازدهم می خونی.

سبحان پرهوده
1 ماه پیش
نیرو درون مولکولی رو میشه با الکترونگاتیوی توجیح کرد یا نه چون بازم جواب همونه

. .
1 هفته پیش
در اصل برمیگرده به انتالپی های پیوندشون

راضیه شیخان
3 ماه پیش
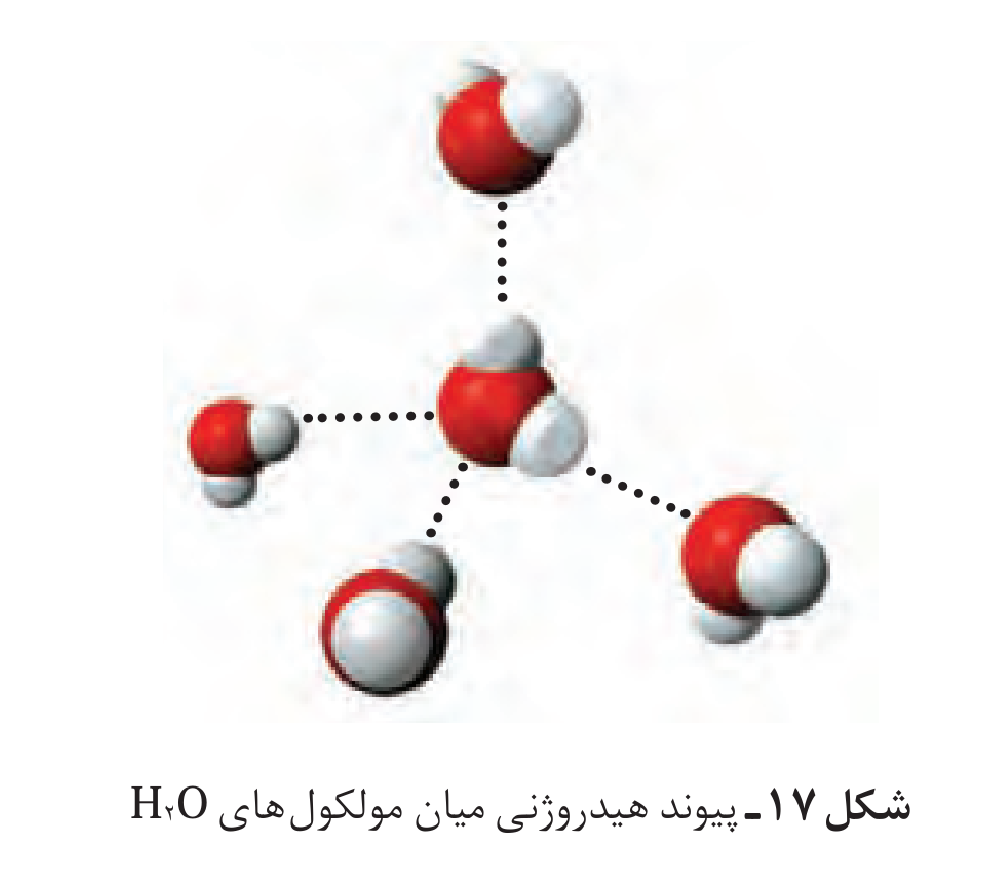
سلام میشه ساختار آب رو توضیح بدید که چجوری یه مولکول آب به مولکول آب دیگه وصل میشه
امیرمحمد ولدپور
4 ماه پیش
از کجا بدونم یکی مثل PH3 بدون هیچ اطلاعاتی مثل نقطه جوش گاز یا هر چیز دیگه

امیرمهدی باغستانی
4 ماه پیش
سلام وقت بخیر ی سوال داشتم چرا استاد اینجا نیروهای درون مولکولی رو نگفتند؟

غزل اسماعیل زاده
4 ماه پیش
سلام:) جلوتر داخل دقیقه 9 توضیح دادن. این مبحث مال سال یازدهمه اگه یازدهم یا کنکوری هستین ب دردتون میخوره.

امیرمهدی باغستانی
4 ماه پیش
@غزل اسماعیل زاده ممنونم ❤️
رمیصا تیمورپور
4 ماه پیش
سلام تست 6 برام باز نمیشه

سید محمد متین رشادی

4 ماه پیش
سلام بنده چک کردم مشکلی نداشت به پشتیبانی اطلاع بدید راهنمایی میکنند 🌷
z z
4 ماه پیش
سلام ببخشید اگر در جدول مندلیف به سمت پایین جدول پیش بریم شعاع بزرگ میشه اگر عنصر ها در یک گروه باشند؟؟؟؟؟

سید محمد متین رشادی

4 ماه پیش
سلام بله 🌷

زهرا خانی
4 ماه پیش
سلام وقت بخیر ترتیب مقدار نیروی بین مولکولی به این صورت هست: جامد>مایع>گاز این مقایسه رو فقط برای مولکول های ناقطبی در نظر میگیریم؟ برای قطبی ها و پیوند هیدروژنی ها چطور؟ چون در کتاب گفته شده که وقتیH²O به صورت گاز درمیاد اصلا جاذبه هیدروژنی نداره

غزل غضنفری
5 ماه پیش
من تست 6ندارم

سید محمد متین رشادی

5 ماه پیش
https://emrooz.ir/cbgstbc-64604 بفرمایید

فاطمه خضرلو
4 ماه پیش
@سید محمد متین رشادی بین تست های تجربی هست و برای ما ریاضی ها بین وییدیو های دوره نیستش

روژان کنگرانی فراهانی
8 ماه پیش
سلام استاد چندین بار در مورد قطبیت بین hcl و hbr و hi اشتباه کردن. قطبیت بیشتر به ترتیب f>o>n>CL>BR>I>S>C>H

Tara :)
7 ماه پیش
سلام استاد نیروی پیوند مولکولی اون ها رو مقایسه کردن نه تک تک اتم ها فکر میکنم متفاوت باشن

آمیار نالوسی
5 ماه پیش
قطبیت برای اتم تعریف نمیشه دوست من و اصلا استاد مقدار قطبیت هارو مقایسه نکرد فقط نیروی بین مولکولی و آنتالپی پیوندشون (قدرت پیوند کووالانسی) رو مقایسه کرد
آموزش ویدیویی نیروی بین مولکولی و نقطه جوش شیمی دهم توسط بهترین اساتید کنکور به همراه جزوه ، تست ، تمرین و رفع اشکال کنکور | کنکور ریاضی - آکادمی امروز













. .
1 هفته پیش
نقطه جوش HBr از نقطه جوش HCl بیشتره. اون منفی 67 عه ولی HCl منفی 85. نیروی بین مولکولیشم از HCl بیشتره