یادبگیریم6:تعیین ردیف و گروه در جدول تناوبی
4.8/5
(387 رای)
برای مشاهده، ابتدا وارد شوید.
ورود و مشاهده فیلم
سوالات دیگران

دانیال قاسمی
6 روز پیش
استاد چرا سه بار مثبت رو به الکترون های x اضافه کردید مگه نباید کمش کنیم.

سید محمد متین رشادی

6 روز پیش
لطفاً تایم مشخص کنید 🌷 ریپلای نباشه 🌷
(1)
(1)
سمیه جعفری
1 ماه پیش
الان دوره ۴ و گروه ۱۶ میشه اکسیژن خب اکسیژن مگ ب ۳pبتوان ۴ ختم نمیشه؟ لطفا جواب بدین

آتنا خرمی
2 ماه پیش
سلام ببخشید مگه این طوری نیست که اگه. بار ما مثبت بود از آخرین زیر لایه به تعداد بار ،از الکترون هامون کم میکردیم؟ و اگر منفی بود به تعداد بار به آخرین زیر لایه اضافه می کردیم؟
(1)



















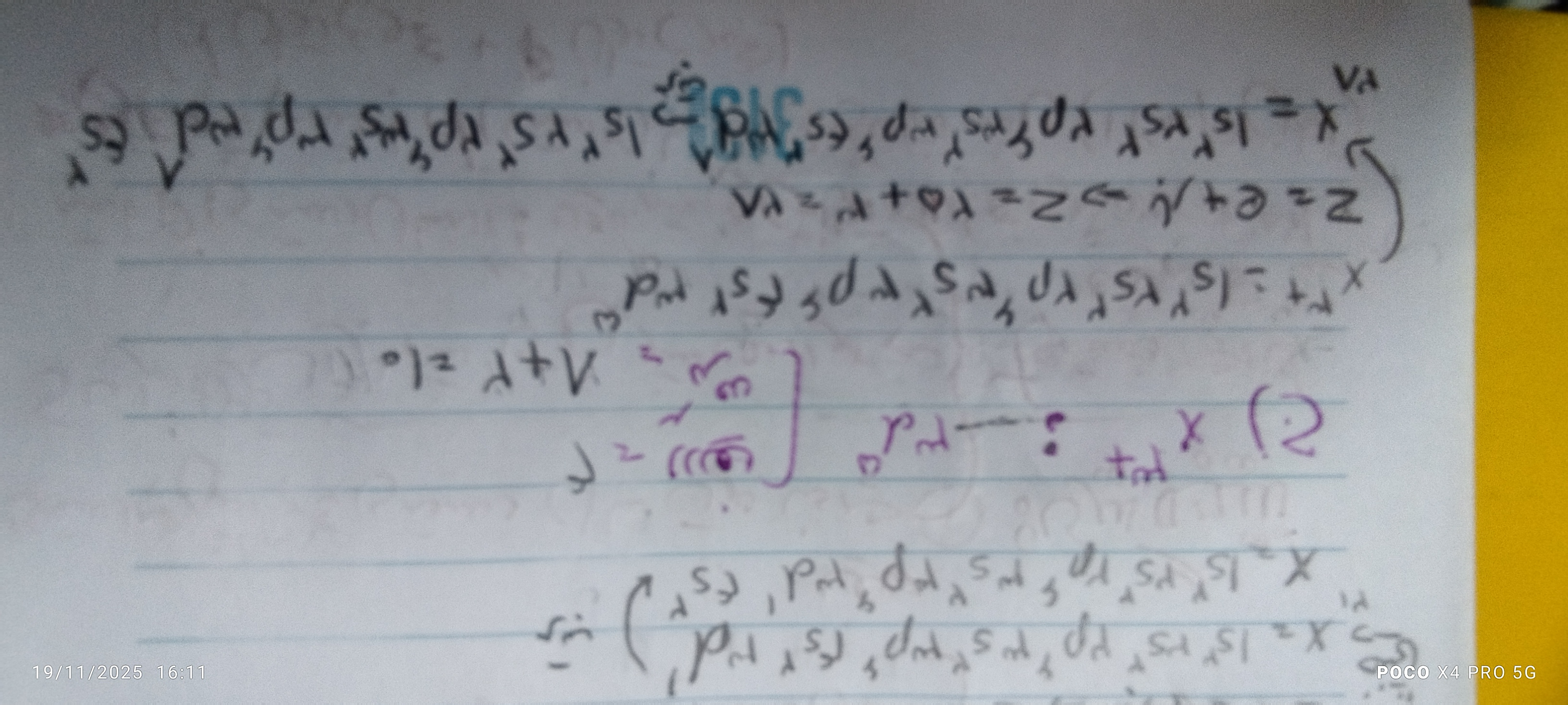



سید محمد متین رشادی
6 روز پیش
تطبیق با پاسخنامه فراموش نشه 🌷 اگر ایرادی وجود داشت اطلاع بدید 🌷