فاطمه مهدیه
4 ماه پیش
لطفا این سوال رو توضیح بدید. ما چطوری میتونیم بفهمیم که چه عنصری تگ چه گروهیه اگه بدون نگاه به جدول بخوایم بگیم؟

سید محمد متین رشادی

4 ماه پیش
ابتدای ویس *

.. .
7 ماه پیش
ببخشید گزینه ه هم میشه اینطوری رد کرد که تعداد الکترون لایه اخر باید باهم برابر باشه که تو یه گروه باشن نه الکترون لایه ظرفیت؟

.. .
7 ماه پیش
@سید محمد متین رشادی پس چطوری هم گروه ها رو تشخیص بدیم؟اگه خواص شیمیایی شون رو بلد نباشیم

.. .
7 ماه پیش
سلام قسمت ج اگه عنصری رو بگیم که مثلا لایه ظرفیتش کنه 3d10 /4ş1 خب اصن این که تعدادش از ۸تا بیشتره؟ ما برا واکنش پذیری مگه نمیگیم اونی که برسه به ۸تایی واکنش پذیریش تموم میشه این قسمت رو میشه توضیح بدید

.. .
7 ماه پیش
@سید محمد متین رشادی بله پیروی نمیکنن ولی اینجا نگفته واسطه باشن یا اصلی

حامد حقیقی
9 ماه پیش
سلام ببخشید اینجا قبلا استاد گفته بود برای گنجایش الکترونی زیر لایه ها از فرمول ۲n به توان ۲ استفاده کنیم ولی اینجا از ۴l+۲ استفاده کردند چرا؟

نرگس مهدوی

9 ماه پیش
سلام اولی که گفتین ظرفیت لایه ها هست دومی ظرفیت زیرلایه ها
یگانه احمدی
1 سال پیش
سلام وقتتون بخیر قسمت( ه) مگه شماره گروه هر عنصر برابر تعداد الکترونهای لایه ظرفیت اتم نیست پس وقتی تعداد الکترونهای لایه ظرفیت برابر باشه رفتار شیمیایی یکسان دارند پس در نتیجه با هم همگروه هستند اما اینجا استاد برخلاف تست ۱۰ قسمت الف الکترونهای لایه ظرفیت در نظر نگرفتند فقط ظرفیت در نظر گرفتند وقتی سوال میگه الکترونهای ظرفیتی ما باید ظرفیت در نظر بگیریم یا الکترونهای لایه ظرفیت؟

سید محمد متین رشادی

1 سال پیش
سلام خب متن مورد ه واضحه و داره در مورد تعداد الکترون های ظرفیتی حرف میزنه و اینکه به یه نکته توجه کن در گروه یک تا ۱۲،تعداد الکترون ظرفیتی با شماره گروه برابره اما دقت کن که از ۱۳ به بعد اینطور نیست مثلا اکسیژن ۶ تا الکترون ظرفیتی داره،اما در گروه ۱۶ هست مثال نقض:کربن و تیتانیم هر دو ۴ الکترون ظرفیتی دارند،اما در یک گروه نیستند 😊🌷

سید محمد متین رشادی

1 سال پیش
به مثال های استاد توجه کنید که برای نقض مورد ه میگن و اینکه الکترون ظرفیتی و الکترون های لایه ظرفیت،تقریبا یک مفهوم دارند (یعنی اگر هر کدومش رو میگفت در مورد ه ،فرفی نداشت)
سعید اسد
1 سال پیش
سلام قبلا گفته بودیم که انرژی الکترون ها به طور کلی با افزایش فاصله از هسته بیشتر میشه.اما اینجا طبق گزینه ۲ مثلا انرژی ۴s از ۳d کمتره.در حالی که طبق قاعده قبلی چون ۴s از هسته دورتره پس باید انرژی بیشتری داشته باشه.؟؟

نرگس مهدوی

1 سال پیش
سلام چون نحوه پرشدن زیرلایه به این شکله که تول 4s پر میشه و بعد 3d برای همین این قضیه اتفاق میفته

دنیا قریبی راد
1 سال پیش
من تحیلی گزینه دوم رو متوجه نشدم . لطفا کسی توضیح بده🤍

آنا ملکی
1 سال پیش
اول باید این نکته رو بلد باشی که ((هرچه زیر لایه زودتر پر شود آن زیرلایه انرژی کمتری دارد))چون اتم تمایل دارد در پایدارترین حالت خود باشد پس الکترون ها را در کم انرژی ترین حالت خودش میچینه.پس اگر زودتر زیر لایه ای پر بشه یعنی کمتر انرژی داره حالا باید ببینیم بین این 3 تا یعنی 5d و 6p و 4f کدوم زود تر پر میشه که برای این کار دو روش هست یکی: 1. n+l کمتر زود تر پر میشود و در صورت برابر شدن n کمتر 2. استفاده از اصل آفبا ns (n-2)f (n-1)d np
(1)

دنیا قریبی راد
1 سال پیش
@آنا ملکی ممنون عزیزمم😘♥

آنا ملکی
1 سال پیش
@دنیا قریبی راد خواهش میکنم.

نفس
1 سال پیش
سلام ببخشید توی گزینه اول مگه نباید به این توجه کنیم ک لایه ظرفیت تعداد e هایی هست ک به شکل توان بالا قرار میگیره؟!

سید محمد متین رشادی

1 سال پیش
سلام منظورت از توان بالا چیه؟

سید امیررضا هاشمی
1 سال پیش
سلام عنصر اصلی یعنی چی؟

سید محمد متین رشادی

1 سال پیش
سلام یعنی عناصر گروه یک و دو و سیزده تا هجده
مرجان البوعلی
1 سال پیش
سلام میشه گذینه ب رو توضیح بدین از روش کتاب یا استاد
(1)
(1)
مرجان البوعلی
1 سال پیش
@سید محمد متین رشادی خیلی ممنون
(1)

امیررضا طهماسبی
1 سال پیش
@زینب مقدم اها ربط به خصلت فلزی و نافلزی داره اوکیه

زینب مقدم

1 سال پیش
@امیررضا طهماسبی 👍👍
(1)

زهرا باقری
1 سال پیش
سلام وقت بخیر گزینه ه رو بیشتر توضیح میدین نگفته قطعا در یک گروه باشن ک غلط بگیریم حالا هلیم یه مثال نقضه براش ولی برا بقیه مگه درست نمیشه مگه عناصری ک در یک گروه جای دارن الکترون های ظرفیتی شون برابر نیس؟

سید محمد متین رشادی

1 سال پیش
خیر برای عناصر واسطه هم درست در نمیاد مثلا تیتانیم ۴ تا الکترون ظرفیتی داره و کربن هم چهارتا داره اما هم گروه نیستن

زهرا باقری
1 سال پیش
@زینب مقدم درسته مرسیی عزیزم 🥰🌹

زینب مقدم

1 سال پیش
@زهرا باقری خواهش میکنم💚😚

یاسمن شهدادزایی
1 سال پیش
عناصر برچه اساسی در یک گروه قرار میگیرن

یاسمن شهدادزایی
1 سال پیش
منظورم اینه چرا میگنmg دوبار مثبت

زینب مقدم

1 سال پیش
بر اساس تعداد الکترون لایه اخرشون

زینب مقدم

1 سال پیش
@یاسمن شهدادزایی چون منیزیم ۲ تا الکترون تو لایه آخرش داره و موقع یون شدن هر دوی این الکترونها رو از دست میده و به آرایش گاز نجیب دوره قبلش(نئون) میرسه

فاطمه جعفرزاده
1 سال پیش





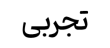



سید محمد متین رشادی
4 ماه پیش
اگر ویس ناواضح بود بگید دوباره ضبط کنم 🌷 ریپلای نباشه 🌷 ابتدای ویدیو منظورم 1 تا 12 بود اشتباهی گفتم 1 تا 10