
محدثه اباذری

3 سال پیش
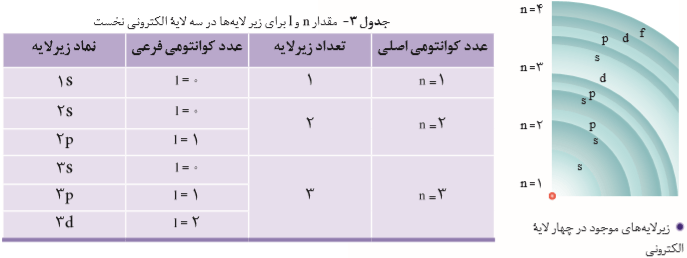
سلام :) اتم مثل کرهای هست که الکترونها در لایههایی اطراف هسته توزیع شدند. لایهها رو از هسته به سمت بیرون شمارهگذاری میکنن و شماره هر لایه رو با n نشون میدن. n عدد کوانتومی اصلیه. برای لایه اول n=1، برای لایه دوم n=2 و ... برای لایه هفتم n=7. هر لایه از تعدادی زیرلایه تشکیل شده. فرمکلی زیرلایه nl هست. n (عددکوانتومی اصلی) نشوندهنده شماره لایهای هست که زیرلایه به اون تعلق داره. l نشوندهنده عدد کوانتومی فرعیه. زیرلایه اول هر لایه دارای عدد کوانتومی فرعی صفر (l=0) و نماد s است. زیرلایه دوم دارای عدد کوانتومی فرعی یک (l=1) و نماد p است. زیرلایه سوم دارای عدد کوانتومی فرعی دو (l=2) و نماد d است. زیرلایه چهارم دارای عدد کوانتومی فرعی سه (l=3) و نماد f است. زیرلایهها برای پذیرفتن الکترون محدودیت دارند و نمیتونن بیش از تعداد معلوم، الکترون بگیرند. و تعداد پذیرش هر زیرلایه متفاوت است. از فرمول 4l+2 حداکثر الکترونهای هر زیرلایه، محاسبه میشه. یعنی زیرلایه s حداکثر ۲ الکترون، زیرلایه p حداکثر 6 الکترون، زیرلایه d حداکثر ۱۰ الکترون و زیرلایه f حداکثر ۱۴ الکترون میتونه بگیره. ترتیب پرشدن زیرلایهها طبق قاعده آفباست که استاد توضیح دادن.

مهدی عباسی
3 سال پیش
توضیح تون مفید و عالی بود 🔥👌

هانیه بختیاری
3 سال پیش
خیلی خوب بود مرسی 😍💛

ستایش کریمیان
2 سال پیش
ممنون از توضیحات کامل و مفیدتون❤️

Zahra FarzanMehr
2 سال پیش
ممنون از توضیحتون❤️
آرش باغبانیان
1 سال پیش
ممنون بابت توضیح کاملتون

سید محمد متین رشادی

1 سال پیش
@آرش باغبانیان 🌷🌷🌷

کوثر موسوی
1 سال پیش
آقا عالی

سید محمد متین رشادی

1 سال پیش
@کوثر موسوی 🌷
مبینا صدرجهانی
1 سال پیش
سلام وقتتون بخیر میشه به صورت صوتی توضیح بدید

زینب مقدم

1 سال پیش
@مبینا صدرجهانی سلام مبینا جان کجا رو؟ متوجه سوالت نشدم
شفیقه جعفریان
1 سال پیش
بسسسسسیار عالی . دمت گرم

سارا مقدم متقی
1 سال پیش
خیلی ممنون بابت توضیحات ولی کاش همین رو استاد یک تایمی میذاشتند در ویدئو کامل توضیح میدادن که یدفعی گیج نشیم 🤦♂️

محسن لطفی
7 ماه پیش
چقدر بیکار

علیرضا قوی دل
1 ماه پیش
@مهدی عباسی خاهش میکنم

آرمیتا اسدی
1 ماه پیش
چرا از 4s دو تاشو برداشتیم ؟ مگه 3d بعدش نمیاد خب باید از اون برمیداشتیم

علیرضا قوی دل
1 ماه پیش
اول şها پر میشن بعد dپر میشه

شیرین مهندس سامان
1 ماه پیش
بی زحمت Mo را برام توضیح میدین من با آرایش فشرده حل میکنم جوابم استاد نمیشه
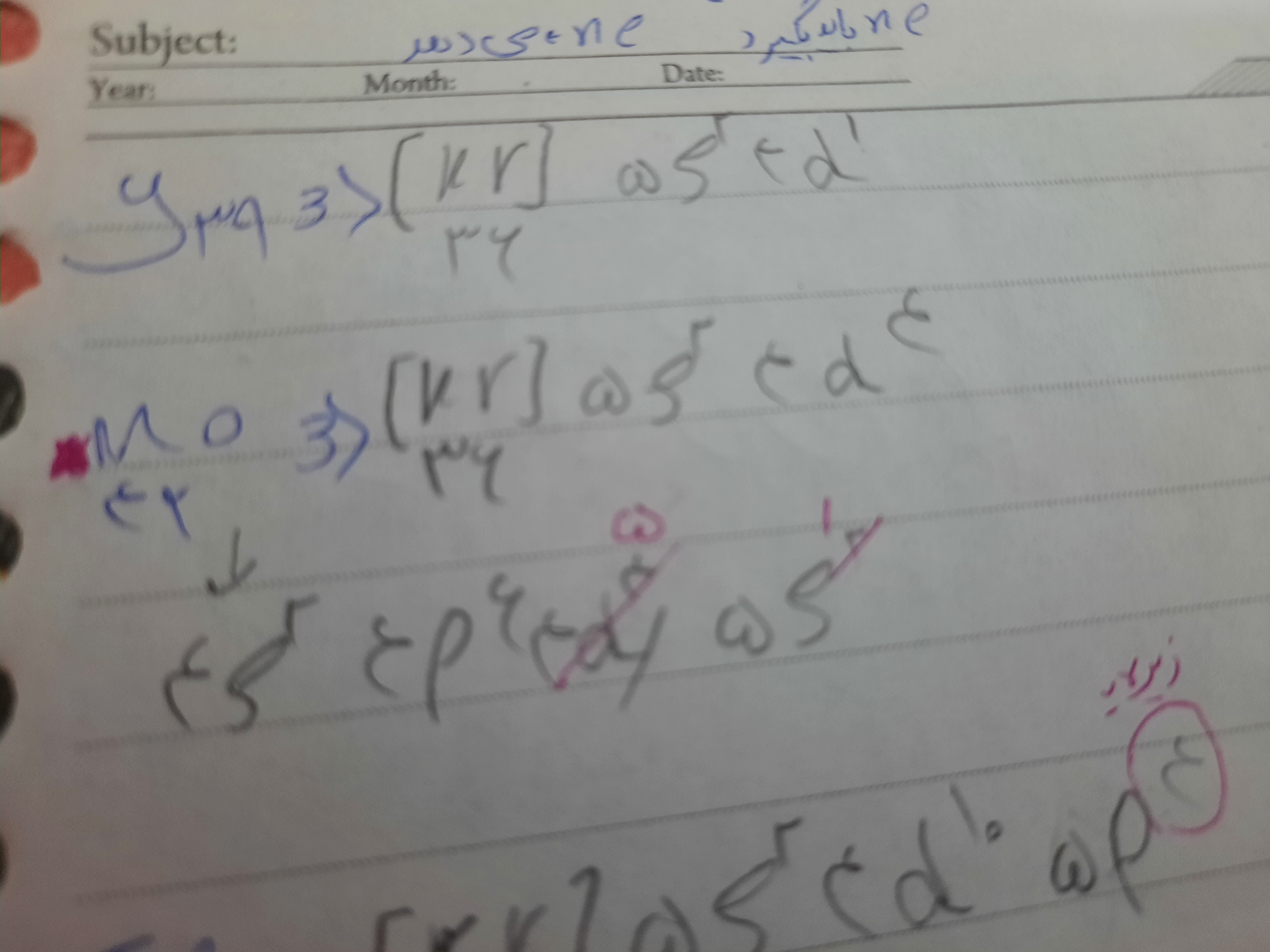

شیرین مهندس سامان
1 ماه پیش
@سید محمد متین رشادی خیلی ممنون فقط بی زحمت می تونم بپرسم دلیلش چیه چرا باید از sیه الکترون به لایه dبره
سمیه جعفری
1 ماه پیش
بچه ها تستای اینجا کافیه شما چقد تست میزنین اصن همشو مفهومی متوجه میشین یا فقط من اینجوریم توروخدا یکی جواب بده خواهشا
سمیه جعفری
1 ماه پیش
قاعده استثنا مگ فقط برای کروم و مس نیس؟ یجا استاد گفت عناصر از ۲۰ تا ۲۹ اگه استثنا داشت میشه یجا هم برای ارایش ی عنصر با عدد اتمی ۴۰ این کارو انجام دادن پس عناصر زیادی هستن ک از قاعده افبا پیروی نمیکنن؟؟؟؟؟
نسا پیری
1 ماه پیش
خیلی توضیحاتی که می گید مختصر کلن این توضیحات برای اون شخصی که می خواد رو مرور کن معلم خودم که این همه گله می کنم ازش چند برابر بهتر شما راه حل ها گنگ می گید درضمن به خاطر وقت وتدریس ممنون
آموزش ویدیویی آرایش الکترونی شیمی دهم توسط بهترین اساتید کنکور به همراه جزوه ، تست ، تمرین و رفع اشکال کنکور | کنکور ریاضی - آکادمی امروز














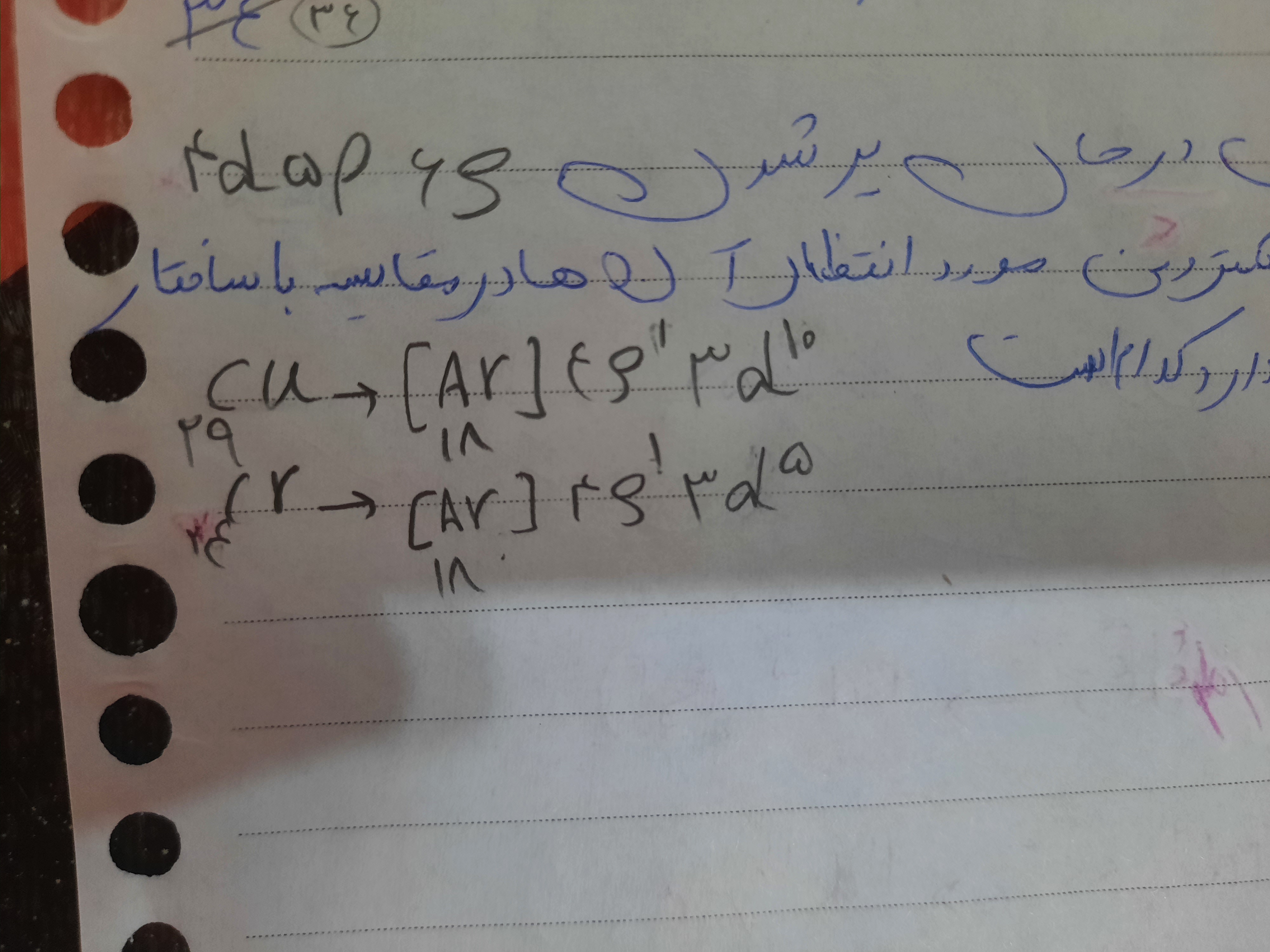
مهنا زین الدین
3 سال پیش
خیلی ممنون از توضیح کاملتون